Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Ферменты: белковые катализаторы клеток
Ингибирование и активация ферментов
Конкурентные ингибиторы
Активность большинства ферментов подавляется множеством соединений. Этот процесс часто отличается высокой специфичностью, и изучение связи между структурой ингибитора и его ингибирующей способностью оказалось весьма плодотворным для выяснения природы активных центров и выявления комплементарности поверхностей биологических молекул. Ингибирование ферментов лежит также в основе действия большинства лекарств.
Ингибирование бывает обратимым и необратимым. Последнее относится к реакциям, приводящим к безвозвратной потере активности фермента [33а]. Примером необратимого ингибирования может служить инактивация фермента ацетилхолинэстеразы под влиянием ядов нервно-паралитического действия — фосфорорганических соединений (гл. 7, разд. Г, 1). Часто стадии необратимой инактивации предшествует обратимое связывание ингибитора с комплементарным ему центром на поверхности молекулы фермента. Здесь мы не будем рассматривать математическую обработку кинетических данных, соответствующих необратимому ингибированию, и ограничимся обсуждением количественных аспектов действия обратимых ингибиторов.
Ингибиторы, структурно аналогичные субстрату, способны связываться с субстрат-связывающим центром. В случае истинного конкурентного ингибирования должна иметь место конкуренция между субстратом и ингибитором за связывание с одним и тем же центром, а кроме того, связывание одного из этих лигандов должно исключать связывание другого. Сродство ингибитора к ферменту количественно выражается константой ингибирования К1, которая представляет собой константу диссоциации комплекса фермента с ингибитором ЕІ:
![]()
Если использовать допущение о стационарности и учесть в уравнении материального баланса для фермента не только свободный фермент и комплекс ES, но и комплекс EI, то нетрудно убедиться в том, что в случае конкурентного ингибирования зависимость скорости от концентрации субстрата аналогична по виду уравнению (6-15). Однако константа КМ должна быть заменена на кажущуюся константу Михаэлиса (К'М) зависящую от концентрации ингибитора:
![]()
Линейные анаморфозы уравнения скорости имеют следующий вид:
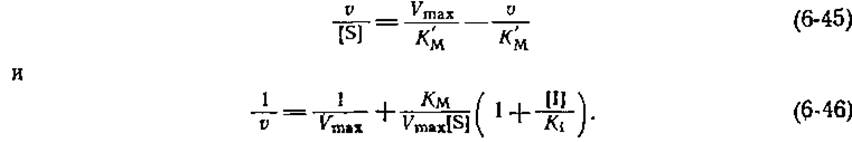
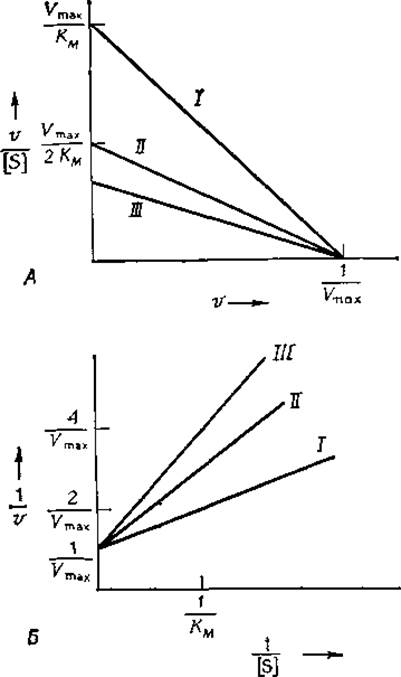
РИС. 6-6. График Эди — Хофсти (А) и график двойных обратных координат (Б) для реакций, протекающих в присутствии конкурентного ингибитора. Кажущаяся константа КМ в соответствии с уравнением (6-44) растет с увеличением концентрации ингибитора, а величина Vmaх остается неизменной. I — в отсутствие ингибитора; II — [I] = K1; III— [I] =2K1.
Чтобы выявить наличие конкурентного ингибирования, обычно строят графики зависимости v/[S] от V, описываемые уравнением (6-45), или 1/v от 1/[S] [уравнение (6-46)] для реакций, протекающих в отсутствие ингибитора и в его присутствии при одной или нескольких фиксированных концентрациях. При наличии конкурентного ингибирования получают семейство прямых, пересекающихся с одной из осей в точке 1/Vmax(рис. 6-6). Иначе говоря, максимальная скорость не изменяется в присутствии конкурентного ингибитора. Если взять достаточно высокую концентрацию субстрата, то всегда можно насытить фермент субстратом и полностью исключить связывание ингибитора. Из изменения наклона с ростом концентрации ингибитора нетрудно при помощи уравнений (6-45) или (6-46) рассчитать величину K1.
При фиксированной концентрации конкурентного ингибитора график зависимости v от lg[S] (рис 6-7) просто смещается вправо вдоль оси абсцисс (т. е. в сторону больших значений [S]) без какого-либо изменения формы кривой (или величины Vmах).