Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Ферменты: белковые катализаторы клеток
Ингибирование и активация ферментов
Неконкурентное ингибирование и активация
Если ингибитор связывается не только со свободным ферментом, но и с фермент-субстратным комплексом ES, то ингибирование называют неконкурентным. В этом случае связывание S и I не является взаимоисключающим, оба этих лиганда могут быть одновременно связаны молекулой фермента. Почему подобный ингибитор замедляет ферментативную реакцию? В большинстве случаев ингибитор отличается по своей структуре от субстрата. Это обстоятельство позволяет предположить, что ингибитор связывается с аллостерическим центром, т. е. центром, отличным от центра связывания субстрата, и подавление активности фермента обусловлено искажением его трехмерной структуры, вызываемым связыванием ингибитора; это искажение может передаваться активному центру, хотя центр связывания ингибитора удален от активного центра. Помимо этого связанный ингибитор способен влиять на каталитический процесс, частично экранируя активный центр. Как бы то ни было, превращение комплекса ESI протекает медленнее, чем каталитический распад комплекса ES с образованием продукта, или не протекает вообще.
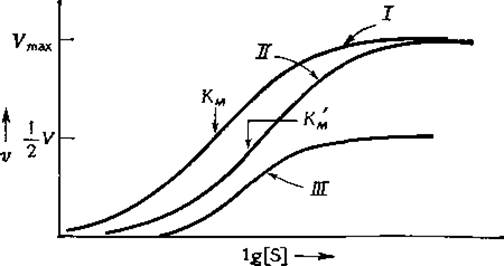
РИС. 6-7. График зависимости о от lg [S] для реакций, протекающих в присутствии конкурентного или неконкурентного ингибиторов. I — в отсутствие ингибитора; II — в присутствии конкурентного ингибитора ([I]/K1=1); III — в присутствии неконкурентного ингибитора ([I]/K1=1).
Связывание какого-либо соединения аллостерическим центром иногда приводит не к подавлению активности фермента, а, напротив, к ее увеличению. Количественный анализ кинетики подобной активации проводится так же, как и в случае ингибирования. Аллостерические ингибиторы и активаторы часто рассматривают совместно и называют их модификаторами или эффекторами. Принципиальная схема действия модификатора М выглядит следующим образом [34]:
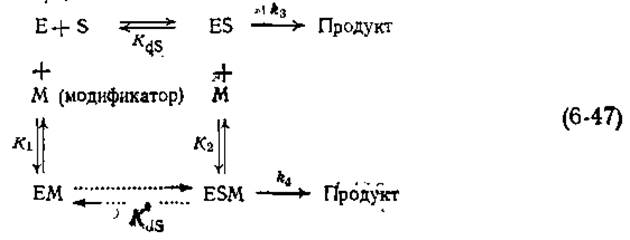
В этой схеме К1 и К2 представляют собой константы равновесия для процесса обратимого отщепления М от комплексов ЕМ и ESM соответственно, a KdSи KdS— аналогичные константы для процесса отщепления S от комплексов ES и ЕSМ. Заметим, что константа диссoциации для равновесного процесса ESM⇄EM+S не является независимой величиной и связана с остальными константами равновесия следующим соотношением:
KdS = KdSK2/K1 (6-48)
Для простоты предполагается, что стадии связывания S и М являются равновесными, (разд. А, 10, г).
Рассмотренное выше конкурентное ингибирование соответствует ситуации, когда К2→∞ (и, следовательно, KdS→∞). В этом случае М представляет собой ингибитор, и активация отсутствует. Неконкурентное ингибирование, отвечает случаю, когда комплекс ESM не подвергается каталитическому превращению, т. е. k4=0. Уравнение для 1/v имеет в этом случае следующий вид:
![]()
Из уравнения видно, что величина 1/Vmax умножена на член, содержащий [I] и К2. Таким образом, характерной особенностью неконкурентного ингибирования является уменьшение максимальной скорости по сравнению с максимальной скоростью в отсутствие ингибитора1). Какой бы высокой ни была концентрация субстрата, полностью предотвратить, ингибирование невозможно.
На рис. 6-8 представлены зависимости 1/v от 1/[S] для реакций, протекающих в отсутствие и в присутствии ингибитора. Если К1 = К2(случай чисто неконкурентного ингибирования), то в координатах {1/[S]; 1/v} для различных фиксированных концентраций ингибитора мы получим прямые, пересекающиеся в точке, которая лежит на оси абсцисс и соответствует значению 1/[S], численно равному —1/КМ. Если же К1≠К2 (случай частично конкурентного ингибирования), то семейство прямых пересекается в точке, лежащей в области отрицательных значений 1/[S] и выше или ниже оси абсцисс в зависимости от соотношения между константами K1и К2. Рис. 6-8 соответствует ситуации, когда K2=K1/2, т. е. М связывается с комплексом ES в два раза прочнее, чем с Е.
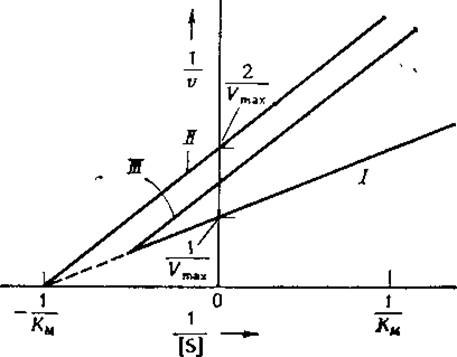
РИС. 6-8. Графики двойных обратных координат для реакций, протекающих в присутствии неконкурентного или частично конкурентного ингибитора. І — в отсутствие ингибитора; II — в присутствии неконкурентного ингибитора ([І]/К2 = [I]/K1 = 1); III — в присутствии частично конкурентного ингибитора ([І]/K2 = 0,5; [I]/K1 = 1).
Из рис. 6-7 видно, как изменяется форма кривой в присутствии неконкурентного и конкурентного ингибиторов. Смещение точки полу- насыщения вправо отражает свойство ингибитора препятствовать связыванию субстрата, а снижение максимальной скорости в случае неконкурентного ингибитора связано с тем, что субстрат не способен полностью вытеснить ингибитор из комплекса с ферментом даже в том случае, когда его концентрация очень высока.
Если ингибитор связывается только с комплексом ES и не связывается с Е, т. е. K1 = ∞, зависимости 1 /о от 1 /[S], полученные при различных фиксированных концентрациях ингибитора, графически изображаются параллельными прямыми. Этот случай, обычно называемый бесконкурентным ингибированием, для односубстратных ферментных систем встречается довольно редко. Однако процесс ингибирования в многосубстратных ферментных системах, подчиняющихся механизмам типа пинг-понг, довольно часто характеризуется семейством параллельных прямых в координатах {1/[S]; 1/t}.
1) При постоянстве КМ — Прим. перев.
Если константа скорости k4 в схеме (6-47) не равна нулю, может иметь место либо ингибирование, либо активация. При k3 = k4модификатор либо увеличивает кажущуюся константу Михаэлиса (ингибирование), либо уменьшает ее (активация). Максимальная скорость остается неизменной. Моно и др. [35] называют ферментные системы с подобными кинетическими свойствами К-системами. Если же К1 = К2, а то мы имеем истинную V-систему. В общем случае в присутствии модификатора происходит изменение как кажущейся константы Михаэлиса, так и кажущейся максимальной скорости.
Многие ферменты специфически активируются ионами металлов. Зачастую ион металла рассматривается как второй субстрат, который должен связаться с первым субстратом, чтобы осуществился каталитический процесс. В других случаях комплекс молекулы органического соединения с ионом металла считается «истинным субстратом». Так, многие ферментативные реакции идут с участием комплекса АТР с ионом магния (гл. 3, разд. Б, 5), и ферменты могут рассматриваться либо как двухсубстратные (требующие Mg2+ и АТР4-), либо как односубстратные (связывающиеся с MgATP2-).