Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Биосинтез; как образуются новые молекулы
Синтез и утилизация олигосахаридов
Наш обычный пищевой сахар — сахароза — синтезируется во всех зеленых растениях и только в них, где служит в основном транспортной формой сахара; сахароза образуется как в хлоропластах, так и в других местах, где накапливается крахмал, прекрасно растворяется в воде. Поскольку полуацетальные группы двух составляющих ее углеводных колец блокированы, она химически инертна1). Однако с термодинамической точки зрения сахароза является активным соединением, так как потенциал переноса ее глюкозильной группы составляет 29,3 кДж∙моль-1. Транспорт сахара в форме дисахарида имеет для растений то преимущество, что дисахарид создает меньшее осмотическое давление, чем те же количества сахара, транспортируемого в виде моносахарида.
1) Однако сахароза крайне чувствительна к гидролизу, катализируемому кислотам».
В биосинтезе сахарозы [7] участвует UDP-глюкоза и фруктозо-6-фосфат [уравнение (12-8)]:
![]()
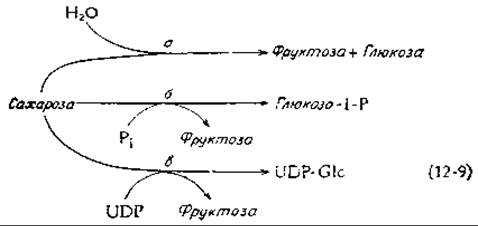
Обмен сахарозы у животных начинается с того, что под действием сахаразы (инвертазы) происходит гидролиз дисахарида на фруктозу и глюкозу [уравнение (12-9), реакция а]. Этот фермент обнаружен также в высших растениях и грибах. Расщепление сахарозы сахарозофосфорилазой [уравнение (12-9), реакция б], имеющее место у некоторых бактерий, приводит к образованию активированного глюкозо-1-фосфата, который далее может непосредственно использоваться в качестве субстрата в процессах катаболизма. Расщепление сахарозы для обеспечения биосинтетических процессов происходит согласно реакции в в уравнении (12-9), в ходе которой образуется (в один этап) UDP-глюкоза.
К числу дисахаридов, обладающих во многом такими же свойствами, как сахароза, относится трегалоза («грибной сахар», см. гл. 2, разд. В,2), которая состоит из двух остатков а-глюкозы, соединенных связью 1→1. Трегалоза химически более инертна, чем сахароза, и, в частности, очень устойчива к кислотному гидролизу. Путь биосинтеза трегалозы [уравнение (12-10)] полностью аналогичен таковому сахарозы. Трегалоза содержится в грибах, а также у многих насекомых [8]. В гемолимфе насекомых это соединение служит не только транспортной формой сахаров, но и выполняет роль антифриза.

Основной углевод молока лактоза образуется путем переноса гликозильного остатка от UDP-галактозы непосредственно на глюкозу [уравнение (12-11), реакция а]. Аналогичный перенос галактозильного остатка на N-ацетилглюкозамин [уравнение (12-11), реакция б] протекает во многих животных тканях. Здесь мы сталкиваемся с удивительным примером регуляторной модификации фермента. Трансфераза, катализирующая реакцию б [уравнение (12-11)], в присутствии а-лактальбумина становится лактозосинтетазой, т. е. ферментом, катализирующим реакцию а уравнения (12-11). Лактальбумин был обнаружен в молоке задолго до того, как была выявлена его регуляторная функция.

Во многих высших растениях имеется трисахарид рафиноза и близкие ей олигосахариды. Рафиноза синтезируется путем переноса галактозильного остатка от UDP-галактозы на гидроксильную группу в положении 6 глюкозного кольца сахарозы [уравнение (12-11), реакция в]. Другой важной реакцией является перенос галактозильного остатка на миониозит [уравнение (12-11), реакция г]. Образующийся при этом галактинол широко распространен в растительном царстве. Галактинол в свою очередь является специфическим донором активированных галактозильных остатков. Так, во многих растениях содержатся стахиоза и высшие гомологи, образующиеся путем последовательного присоединения а-D-галактозильных остатков к 6-ОН-группе галактозы в рафинозе. По-видимому, в растениях эти сахара играют роль антифризов.
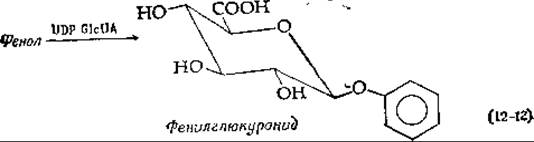
Одной из важных реакций, в которые вступает UDP-глюкуроновая кислота, является образование глюкуронидов (глюкозидуронидов). Глюкурониды представляют собой экскреторные продукты, выводимые с мочой; они образуются путем замещения UDP-остатка в UDP-глюкуроновой кислоте такими соединениями, как фенол или бензойная кислота. При этом в случае фенола синтезируется фенилглюкуронид, а в случае бензойной кислоты (которая частично выделяется в виде гиппуровой кислоты; см. дополнение 9-А) образуется эфир в ходе такой же реакции замещения [уравнение (12-12)].
К числу интересных производных сахаров, встречающихся в природе, относятся многочисленные антибиотики, часто содержащие также аминогруппы (например, дополнение 12-А; рис. 12-10) [9, 10].
Дополнение 12-А
Биосинтез стрептомицина
Стрептомицин относится к семейству аминогликозильных антибиотиков, широко используемых в медицине. Членами этого семейства являются также канамицины, неомицины и гентамициныа. Все они представляют собой водорастворимые углеводы основной природы, содержащие три или четыре циклических сахара необычного типа. Основным предшественником стрептомицина является D-глюкоза: из нее образуются все три стрептомициновых кольца. Каким образом синтезируется 2-дезокси-2-метиламино-b-глюкоза, до сих пор еще не ясно, но пути синтеза двух других колец — L-стрептозы и стрептидина — полностью охарактеризованыб,в. Предшественником стрептидина служит нуклеозиддифосфатмоносахарид — промежуточный продукт синтеза L-рамнозы [уравнение(12-7)]. Углерод-углеродная связь подвергается альдольному расщеплению между С-2 и С-3, как показано на следующей схеме (этап а):
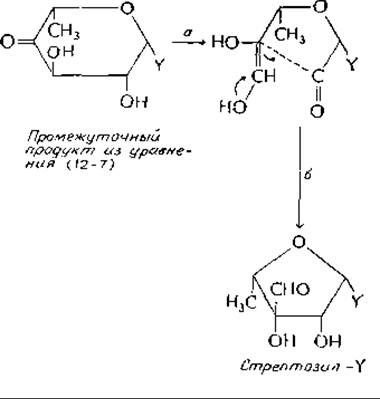

Заметьте, что соединение с незамкнутым кольцом изображено в виде ендиола, который в последующей альдольной реакции б рециклизуется в пятичленное кольцо с заместителем у С-3. Образовавшийся таким путем L-стрептозилнуклеозиддифосфат служит донором стрептозы при синтезе стрептомицина.
Стрептидин, представляющий собой циклический спирт основной природы, образуется из миоинозита [уравнение (12-3)], который в свою очередь образуется из глюкозо-6-фосфата. Введение гуанидиновых групп происходит путем окисления соответствующих гидроксилов в карбонильные группы и последующего переаминирования со специфическими донорами аминогрупп. В реакции, изображенной в следующем уравнении, донором аминогрупп в процессе переаминирования служит глутамин, а в качестве кетокислоти образуется а-кетоглутарамовая кислота:
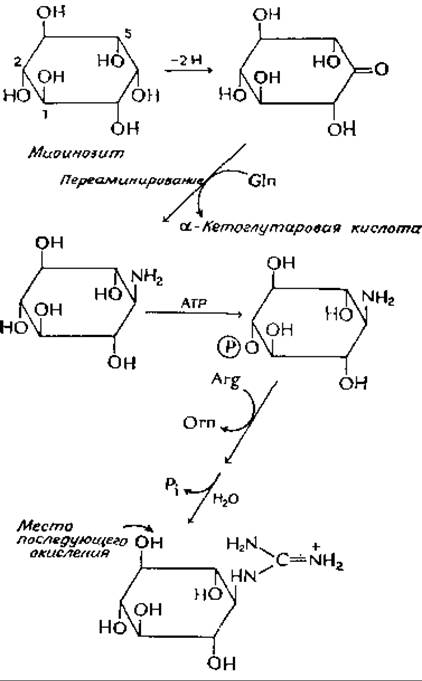
К аминогруппе, введенной в кольцо, далее присоединяется амидиновая группа ![]() аргинина, причем перенос осуществляется посредством нуклеофильного замещения. Этому, однако, предшествует фосфорилирование по положению 2; после переноса амидиновой группы и образования гуанидиновой группы происходит отщепление фосфатной группы под действием фосфатазы. Здесь мы опять сталкиваемся с последовательностью реакции фосфорилирования — дефосфорилирования (гл. 11, разд. Б,3), обеспечивающих протекание основного процесса в заданном направлении. Включение второй гуанидиновой группы протекает совершенно аналогичным путем окисления в третьем положении с последующим переаминированием (причем в этом случае донором аминогрупп служит аланин), фосфорилированием и переносом амидиновой группы от аргинина. Однако конечная стадия — гидролитическое отщепление фосфатной группы, которая в этом случае находится в положении С-6,— осуществляется только после завершения синтеза стрептомицинфосфата, т. е. после присоединения двух других циклических сахаров. Последнее происходит путем переноса от нуклеозиддифосфатных предшественников.
аргинина, причем перенос осуществляется посредством нуклеофильного замещения. Этому, однако, предшествует фосфорилирование по положению 2; после переноса амидиновой группы и образования гуанидиновой группы происходит отщепление фосфатной группы под действием фосфатазы. Здесь мы опять сталкиваемся с последовательностью реакции фосфорилирования — дефосфорилирования (гл. 11, разд. Б,3), обеспечивающих протекание основного процесса в заданном направлении. Включение второй гуанидиновой группы протекает совершенно аналогичным путем окисления в третьем положении с последующим переаминированием (причем в этом случае донором аминогрупп служит аланин), фосфорилированием и переносом амидиновой группы от аргинина. Однако конечная стадия — гидролитическое отщепление фосфатной группы, которая в этом случае находится в положении С-6,— осуществляется только после завершения синтеза стрептомицинфосфата, т. е. после присоединения двух других циклических сахаров. Последнее происходит путем переноса от нуклеозиддифосфатных предшественников.
Стрептомицин может быть инактивирован под действием ферментов, синтез которых зависит от факторов генетической устойчивости (резистентности) (гл. 15, разд. Г,7). К этой категории относятся, в частности, ферменты, катализирующие перенос фосфатной или Зденилильной групп на стрептомицин в участках, показанных на структурной формуле стрелками. Отсюда следует, что, в то время как дефосфорилирование приводит к образованию активного антибиотика, фосфорилирование другого участка приводит к инактивации антибиотика.
а Benveniste R., Davies Annu. Rev. Biochem., 42, 471—506 (1973).
б Luckner M., Secondary Metabolism in Plants and Animals, pp. 78—80, Academic Press, New York, 1972.
в Walker J. B., Skorvaga M., JBC, 248, 2441—2446 (1973).