Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Ферменты: белковые катализаторы клеток
Основы ферментативной кинетики
Линейные формы уравнений скорости
Чтобы найти параметры КМ и Vmах из экспериментально полученных значений скорости, можно преобразовать уравнение (6-15) в одну из линейных форм, например
![]()
Построение графика двойных обратных координат (1/[S]; 1/v) (графика Лайнуивера— Бэрка; рис. 6-3, Л) позволяет определить величины КМ/Vmax и 1/Vmax, они равны наклону прямой и длине отрезка, отсекаемого ей на оси ординат, соответственно. Лучше использовать график зависимости v/[S] от v (график Эди — Хофсти), который близок графику Скэтчарда (рис. 4-3)
![]()
Несмотря на то что точку с координатами [S] = 0, v = 0 нельзя отложить на графике, отношение v/[S] при v→0 стремится к вполне определенной величине, равной Vmax/KM. Обратите внимание на распределение точек на прямых, изображенных на рис. 6-3. Концентрации субстрата выбирались с таким расчетом, чтобы увеличение скорости от точки ж точке было более или менее постоянным (к чему следует стремиться при проведении эксперимента). На графике Эди — Хофсти, как и на исходном графике зависимости v от [S], точки распределены довольно равномерно, а на графике Лайнуивера — Бэрка они сконцентрированы в начале прямой. Второе преимущество графика Эдн — Хофсти состоит в том, что он позволяет отложить на одной прямой точки, охватывающие полный интервал возможных значений концентрации субстрата, — от нулевой до бесконечно большой.
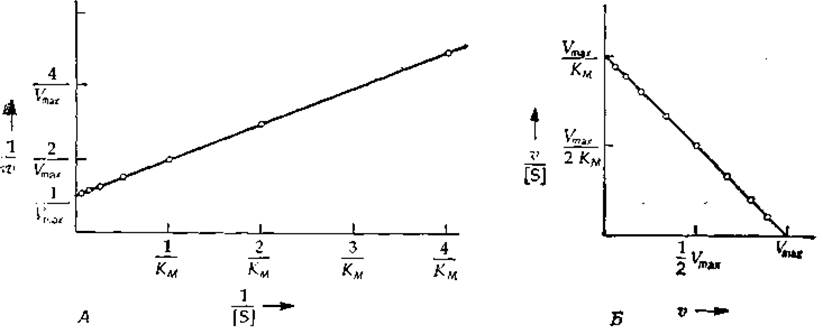
РИС. 6-3. Линейные анаморфозы уравнения Мнхаэлиса — Ментен. А. График зависимости 1/v от 1/[S] (график двойных обратных координат, или график Лайнуивера — Бэрка). Отрезок, отсекаемый прямой на оси ординат, равен 1/Vmaх, а наклон — KM/Vmах. Б. График зависимости v/[S] от о (график Эди — Хофстн). Наклон прямой равен —1//KM, а отрезки, отсекаемые на осях ординат и абсцисс, равны соответственно Vmах/КM и Vmах.
При рассмотрении данных по контролю метаболизма путем регуляции ферментативной активности часто пользуются графиком зависимости V от lg[S] (рис. 6-4). Он также позволяет охватывать полный интервал возможных концентраций субстрата (если не считать точки, отвечающей [S] =0, т. е. lg[S] =—∞). Поэтому для всех ферментов независимо от того, в каком интервале концентраций субстрата происходит их насыщение, может быть использована одна и та же шкала. Зависимость V от lg[S] является S-образяой как для простых случаев, описываемых уравнением (6-15), так и для ферментов, связывающих субстрат кооперативно (разд. Б, 5). В этом случае приходится отказаться от использованной выше классификации кривых («гиперболические» и «сигмоидные»). Правда, из наклона кривых зависимости v от lg[S] в средней точке можно прямо оценить степень кооперативности (гл. 4, разд. В, 7), но, поскольку из графика подобного типа неудобно определять величину Vmax 1), кинетические параметры лучше определять с помощью линейной анаморфозы, построенной в координатах {v; v/[S]} (рис. 6-3, Б). Можно использовать также статистические методы, основанные на применении ЭВМ и позволяющие рассчитать оба параметра (KM и Vmах) и наилучшим образом построить кривую по экспериментальным точкам (рис. 6-4). При описании данных по кооперативному связыванию субстратов без ЭВМ обойтись практически невозможно (разд. Б, 5).
1) Более надежные значения КМ и Vmах, чем график Лайнуивера — Бэрка, дает также следующая линейная анаморфоза:
![]()
(см. Cornish-Bowden A. Principles of enzyme kinetics, Butterworths, London, 1976 p. 26, 182; Ainsworth S. Steady-state enzyme kinetics, Macmillan Press, London, 1977 0). 176). — Прим. пepeв.
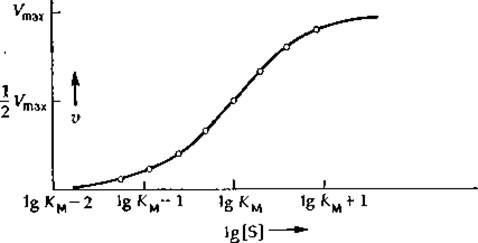
РИС. 6-4. График зависимости v от lg [S] для ферментативной реакции. В соответствии с уравнением (6-44) в присутствии конкурентного ингибитора вся кривая сдвинется вправо вдоль оси абсцисс, так что для полного насыщения фермента субстратом потребуются более высокие концентрации субстрата.