БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 27. СИНТЕЗ БЕЛКА
27.8. Рибосомы - органеллы, в которых происходит синтез белка, - состоят из большой и малой субчастиц
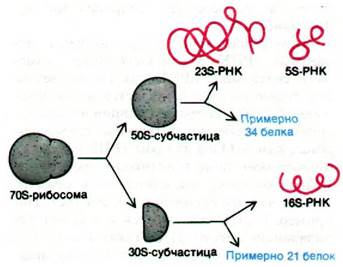
Перейдем теперь к механизму синтеза белка. Этот сложный процесс происходит в рибосомах, которые можно рассматривать как органеллы синтеза белка, подобно тому как митохондрии считают органеллами окислительного фосфорилирования. Рибосома - весьма специализированная и сложная структура. Ее диаметр - примерно 200 А. Лучше всего изучены рибосомы E. coli. Масса этой рибосомы составляет 2500 кДа, а коэффициент седиментации 70S. Ее можно диссоциировать на большую (50S) и малую (30S) субчастицы.Далее эти субчастицы можно диссоциировать на составляющие их белки и РНК. 30S-субчастица содержит 21 белок и одну молекулу 16S-PHK. 50S-субчастица содержит примерно 34 белка и 2 молекулы РНК (23S и 5S). Рибосома E. coli примерно на две трети состоит из РНК и на одну треть - из белка.
Рибосомы цитоплазмы эукариотических клеток несколько крупнее бактериальных рибосом. Интактная эукариотическая рибосома имеет коэффициент седиментации 80S. Подобно бактериальной рибосоме, она диссоциирует на большую (60S) и малую (40S) субчастицы. Малая субчастица содержит одну молекулу 18S-PHK, а большая субчастица - три молекулы РНК (28S, 7S1)и 5S). Рибосомы митохондрий и хлоропластов отличаются от цитоплазматических рибосом эукариот. Они больше похожи на 70S-частицы, а не на 80S. Между синтезом белка в митохондриях, хлоропластах и бактериях имеется много общего.
1 Эту рРНК по сложившейся традиции чаще обозначают 5,8S-PHK. Прим. перев.
Рис. 27.11. Рибосомы можно диссоциировать примерно на 55 белков и три молекулы РНК
27.9. Рибосомы можно реконструировать из составляющих их молекул белков и РНК
Рибосомную 30S-субчастицу можно реконструировать из смеси 16S-PHK и 21 белка, входящего в ее состав. Сборку этих компонентов с образованием функционально активной 30S-субчастицы впервые осуществил Масаясу Номура (Masayasu Nomura) в 1968 г. Через несколько лет была реконструирована 50S-субчастица. Эти эксперименты имели важное значение в двух отношениях. Во-первых, они продемонстрировали, что вся информация, необходимая для сборки этой органеллы, содержится в структуре ее компонентов. Для сборки не нужны никакие внерибосомные факторы. Таким образом, образование рибосом in vitro представляет собой процесс самосборки. Во- вторых, реконструкцию можно использовать для того, чтобы выяснить, необходим ли тот или иной компонент для сборки рибосомы или собственно для ее функционирования. Например, таким образом был выявлен компонент рибосомы, отвечающий за ее чувствительность к антибиотику стрептомицину (разд. 27.20). Из работ по реконструкции 30S-субчастицы были сделаны следующие выводы.
Рис. 27.12. Разделение белков рибосомной 50S-субчастицы с помощью двумерного электрофореза в полиакриламидном геле
Рис. 27.13. Электрофоретическое разделение в полиакриламидном геле белков нативной рибосомной 30S-субчастицы (слева) и реконструированной 30S-субчастицы (справа). В реконструированной субчастице присутствуют все те же белки, что и в нативной

1. 16S-PHK необходима для ее сборки и функционирования. Эта потребность весьма специфична, так как 16S-PHK из дрожжей не может заменить 16S-PHK из E. coli. Роль молекул рибосомной РНК остается областью пристального интереса со стороны исследователей.
2. В опытах по реконструкции каждый раз из системы исключали один из белков, чтобы выяснить, может ли интактная 30S-субчастица образоваться из остальных 20 белков и 16S-PHK. Оказалось, что по крайней мере шесть белков необходимо для сборки 30S-частицы.
3. Для сборки функционально активной 30S-частицы необходимо большинство входящих в нее белков. Итак, 30S-субчастица представляет собой кооперативную целостную в функциональном отношении структуру.
27.10 Белки синтезируются в направлении от аминоконца к карбоксильному концу
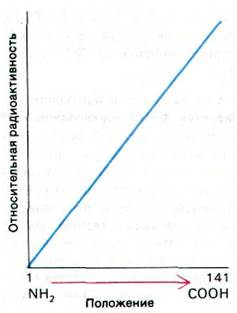
Одним из первых вопросов, касающихся механизма синтеза белка, был вопрос о том, синтезируются ли белки в направлении от аминоконца к карбоксильному концу или наоборот. Четкий ответ на этот вопрос дали опыты Говарда Динциса (Howard Dintzis) с импульсной меткой. Ретикулоциты, активно синтезирующие гемоглобин, инкубировали в присутствии 3Н-лейцина в течение коротких промежутков времени, недостаточных для синтеза полных цепей. Синтезированный в этих условиях гемоглобин разделяли на α- и β-цепи и обрабатывали трипсином. Затем определяли удельную радиоактивность полученных пептидов, т.е. отношение их радиоактивности к общему содержанию лейцина. В пептидах, расположенных в нативном белке вблизи карбоксильного конца, было больше радиоактивности, чем в пептидах вблизи аминоконца. Наблюдалось постепенное возрастание радиоактивности от аминоконца к карбоксильному концу (рис. 27.14). Сильнее всего был помечен карбоксильный конец, так как он синтезировался последним. Следовательно, направление роста цепей — от аминоконца к карбоксильному концу.
Рис. 27.14. Распределение 3Н-лейцина в α-цепи гемоглобина, синтезированного после инкубации ретикулоцитов в течение короткого времени в присутствии метки. Более высокая радиоактивность С-конца по сравнению с N-концом указывает, что С-конец синтезируется последним