БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 28. РЕГУЛЯЦИЯ ВЫРАЖЕНИЯ ГЕНА В ФЕНОТИПЕ
28.5. Последовательность оснований в /ас-операторе симметрична
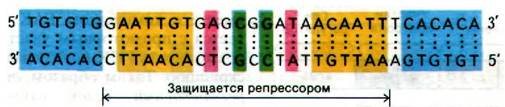
Наличие чистого /ас-репрессора сделало возможным выделение lас-оператора и определение его последовательности оснований. Гилберт и его сотрудники, воздействовав ультразвуком на ДНК фага, содержащего /ас-область, получили фрагменты длиной примерно 1000 пар оснований. К смеси фрагментов добавили /ас-рспрессор и затем профильтровали раствор через нитроцеллюлозную мембрану. Фрагменты ДНК, не связанные с lас-репрессором, прошли через фильтр, а комплексы ДНК-репрессор прочно связались с ним. Связанную ДНК сняли с фильтра с помощью ИПТГ. Эти элюированные фрагменты ДНК обработали панкреатической дезоксирибонуклеазой в присутствии репрессора. Идея этого этапа эксперимента состояла в том, что операторный участок, связанный в комплексе с репрессором, должен быть защищен от расщепления дезоксирибонуклеазой (рис. 28.6). Затем установили последовательность оснований этих операторных фрагментов, определив последовательность транскрибированной с этих фрагментов РНК. Последовательность оснований этого участка оказалась очень интересной: 28 пар оснований расположены симметрично относительно оси второго порядка (рис. 28.7). Симметрия репрессора, по-видимому, соответствует симметрии оператора. Этот принцип узнавания приложим также к сигналам терминирования транскрипции (разд. 28.8) и к связыванию пептидного антибиотика актиномицина D с ДНК (разд. 25.18)1.
Рис. 28.6. lас-Репрессор защищает lас- оператор от расщепления панкреатической дезоксирибонуклеазой
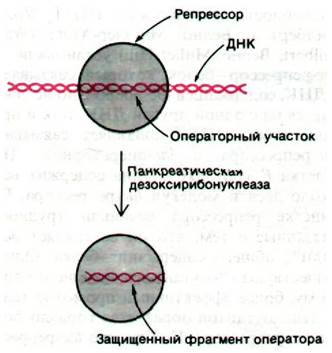
Рис. 28.7. Нуклеотидная последовательность /ас-оператора. Симметричные участки закрашены одинаковым цветом
28.6. Циклический AMP стимулирует транскрипцию многих индуцибельных катаболических оперонов
Давно уже известно, что в клетках Е. coli, растущих на глюкозе, активность катаболических ферментов, таких, как ß-галактозида- за, галактокиназа, арабинозо-изомераза и триптофаназа, находится на очень низком уровне. Очевидно, было бы совершенно излишним синтезировать эти ферменты в условиях изобилия глюкозы2. Молекулярный механизм такого ингибирующего действия глюкозы, получивший название катаболитная репрессия, был расшифрован. Ключом к выяснению этого вопроса явились данные о том, что глюкоза понижает концентрацию циклического AMP в клетках Е. coli. Затем обнаружилось, что экзогенный циклический AMP снимает состояние репрессии, обусловленное присутствием глюкозы. Последующие биохимические и генетические исследования показали, что циклический AMP стимулирует инициирование транскрипции многих индуцибельных оперонов.
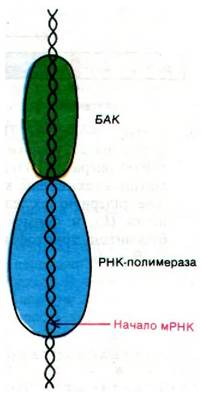
Циклический AMP, синтезированный в отсутствие глюкозы, связывается с БАК (белковый активатор катаболизма) - белком, представляющим собой димер из субъединиц массой 22 кДа. Комплекс БАК с циклическим AMP стимулирует транскрипцию, связываясь вблизи от многих промоторных участков; БАК без AMP такой способностью не обладает. Опытами по расщеплению дезоксирибонуклеазой было установлено, что в случае 1ас-оперона БАК связывается рядом с участком связывания РНК-полимеразы. Точнее, БАК защищает от расщепления нуклеотиды от —87 до —49, а РНК-полимераза - нуклеотиды от—48 до +5 (рис. 28.8). При этой системе нумерации первый транскрибируемый нуклеотид обозначается +1. Последовательность оснований ДНК, узнаваемая БАК, обладает симметрией второго порядка, с которой мы постоянно сталкиваемся при рассмотрении взаимодействий белков с ДНК. Каким образом БАК стимулирует инициацию синтеза лактозной мРНК в 50 раз? Последовательное расположение неперекрывающихся участков связывания БАК и РНК-полимеразы дает основание думать, что связывание БАК с ДНК порождает новые участки взаимодействия РНК-полимеразы с ДНК. Лактозный репрессор, напротив, связывается с нуклеотидами от —3 до +21, которые в значительной степени перекрываются с участком РНК-полимеразы (нуклеотиды от —48 до +5). Таким образом, репрессор препятствует инициации, блокируя связывание РНК-полимеразы. По всей вероятности, комплекс циклический AMP-БАК действует таким же образом и на другие индуцибельные опероны. Итак, индуцибелъные опероны контролируются с помощью комплементарных механизмов, которые используют в качестве сигнальных молекул циклический AMP и специфические индукторы.
Рис. 28.8. На схеме показаны БАК и РНК-полимераза, сидящие на ДНК-матрице. Положение этих белков было определено с помощью расщепления нуклеазой
1 При детальном изучении механизма воздействия 1ас-репрессора с оператором оказалось, что вазимодействию не свойственна такая симметрия, так что пока остается не совсем ясным, почему последовательности lас-оператора (и многих других операторов) обладают элементами симметрии. Прим. перев.
2 Далеко не очевидно, почему клетки E. coli, как и многие другие клетки, предпочитают именно глюкозу всем остальным источникам углерода и энергии и используют ее до тех пор, пока ее содержание не будет исчерпано даже в присутствии значительного избытка других сахаров. Прим. перев.
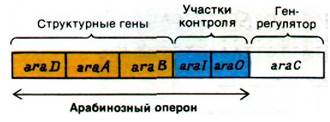
28.7. Различные формы одного и того же белка активируют и ингибируют транскрипцию арабинозного оперона
Бактерии могут использовать арабинозу в качестве источника энергии, превращая ее в ксилулозо-5-фосфат - промежуточный продукт пентозофосфатного пути (разд. 15.4). Превращение арабинозы в кси- лулозо-5-фосфат происходит в результате последовательного действия арабинозо- изомеразы, рибулокиназы и рибулозо-5- фосфат-эпимеразы - ферментов, кодируемых генами araA, araB и araD соответственно. Эти структурные гены вместе с промотором (агаТ) и оператором (агаО) образуют арабинозный оперон (рис. 28.9). Этот оперон регулируется геном (агаС), расположенным рядом с операторным участком. Подобно лактозному оперону, арабинозный оперон может быть активирован комплексом БАК с циклическим AMP. Арабинозный оперон был первым, в отношении которого было установлено наличие и положительной, и отрицательной регуляций. Продукт гена аraС - белок, который существует в двух функционально различных состояниях Р1 и Р2. В отсутствие арабинозы этот белок действует как репрессор (Р;). Форма Р1 связывается с оператором, что препятствует транскрипции оперона. Арабиноза снимает Р1 с оператора и смещает конформационное равновесие в сторону Р2 (активирующей формы). Затем форма Р2 вместе с комплексом БАК-сАМР связывается с промоторным участком, что дает возможность РНК-полимеразе начать транскрипцию. Таким образом, один и тот же регуляторный белок служит положительным и отрицательным регулятором.
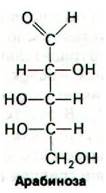
Рис. 28.9. Карта арабинозного оперона и его регуляторного гена