Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Первичная структура белка
Определение аминокислотного состава белка
Определение аминокислотного состава необходимо для характеристики исследуемого белка, а также пептидных фрагментов, получаемых в ходе анализа первичной структуры. Для расщепления до свободных аминокислот пептид или белок подвергают исчерпывающему гидролизу, нагревая его с постоянной кипящей (5,7 М) НС при 105°С в течение 24 ч. Поскольку в таких условиях пептидные связи остатков изолейцина и валина гидролизуются неполно, проводят также 48- и 72-часовой гидролиз. В то же время серин и треонин недостаточно устойчивы и заметно (примерно на 10%) расщепляются уже за 24 ч. Ввиду этого для получения более надежных величин содержание валина и изолейцина оценивают, экстраполируя найденные значения к «бесконечному» времени, а содержание серина и треонина определяют экстраполяцией к «нулевому» времени гидролиза.
Некоторые аминокислоты вообще не выдерживают кислотного гидролиза и разрушаются практически полностью, поэтому для их определения требуются специально разработанные приемы. Прежде всего полностью гидролизуются до свободных аспарагиновой и глутаминовой кислот их амиды — аспарагин и глутамин. Методы их прямого определения в белках до сих пор не разработаны. Для определения триптофана гидролиз белка проводят метансуль- фоновой кислотой СН3—SO3H в присутствии триптамина, защищающего индольное кольцо триптофана от деструкции. Для определения суммы цистина и цистеина белок перед гидролизом подвергают окислению надмуравьиной кислотой НСО—ООН, в результате чего эти остатки превращаются в остатки цистеиновой кислоты:
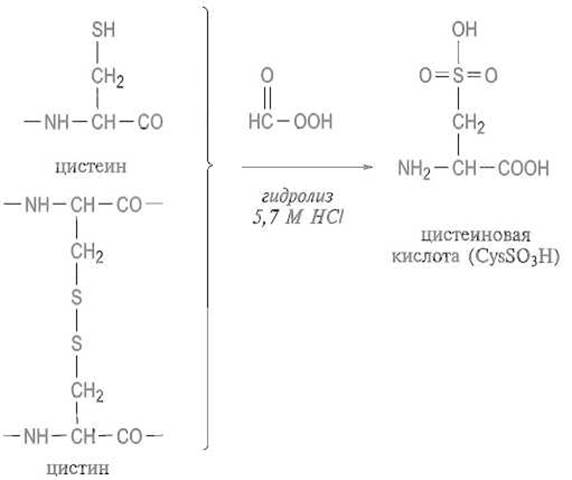
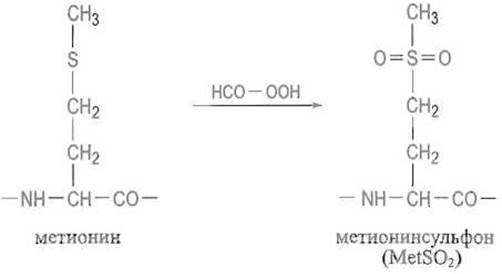
Поскольку определение последней не позволяет судить о содержании раздельно остатков цистина и цистеина, данные аминокислотного анализа выражают в остатках «полуцистина». Окисление надмуравьиной кислотой превращает также остатки метионина в метионинсульфон, не разрушающийся при гидролизе в отличие от метионина:
Для количественного определения аминокислот в кислотном гидролизате белка или пептида используют автоматические анализаторы, впервые описанные У. Стейном, С. Муром и Д. Спекмэном. Их конструкции весьма разнообразны, однако все они основаны на хроматографическом разделении аминокислот на сульфополистирольных катионитах. Элюция аминокислот происходит в порядке, который определяется, во-первых, их кислотно-основными свойствами (аспарагиновая и глутаминовая кислоты элюируются в числе первых; гистидин, лизин и аргинин — последними); во-вторых, гидрофобными взаимодействиями боковых радикалов с полистирольной матрицей ионита (гидрофильные серин и треонин элюируются рано; глицин, аланин, валин, изолейцин, лейцин, тирозин, фенилаланин — примерно в порядке возрастания гидрофобности).
В элюате автоматически проводится цветная реакция аминокислот с нингидрином (см. гл. 1), на которой и основано их количественное определение. Такой способ позволяет определять до 1-10 пмоль аминокислоты. Более чувствительно измерение флуоресценции продукта реакции аминокислот с о-фталевым альдегидом (см. гл. 1), позволяющим определять менее 1 пмоль.
Развивается новый подход к определению аминокислотного состава, при котором аминокислоты превращают в производные, интенсивно поглощающие свет в ультрафиолетовой или видимой области спектра, например в фенилтиокарбамил - (см. гл. 1) или n-диметиламино-фенилазофенилсульфонил(«дабсил»)-производные:

Эти производные разделяют высокоэффективной жидкостной хроматографией на колонках, содержащих С18-производные кремнезема, и определяют содержание аминокислот спектрофотометрически. Метод обладает высокой чувствительностью и скоростью, позволяя определять доли пикомоль — фемтомоли аминокислот.
Оценивая результаты аминокислотного анализа белков и пептидов, необходимо учитывать ограничения, связанные прежде всего с относительной неточностью («грубостью») кислотного гидролиза белков. К сожалению, надежный метод полного ферментативного гидролиза белков, который был бы лишен этого недостатка, до сих пор не разработан. Точность самого метода определения аминокислот, как правило, заметно выше — порядка 2-3%. Учитывая это, следует с осторожностью относиться, например, к данным о небольших (в 1-2 остатка) различиях в составе белков, поскольку они не выходят за пределы возможных погрешностей метода, особенно если речь идет о «трудных» для определения аминокислотах, разрушающихся при гидролизе, образующих труднорасщепляемые пептидные связи или дающих низкий выход окраски при реакции с нингидрином (например, пролин).