Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Третичная структура белка
Топология полипептидных цепей в белках и классификация пространственных структур
Выше были рассмотрены различные способы установления нековалентных контактов между элементами вторичной структуры. Существуют правила, которым подчиняется укладка периодических элементов вторичной структуры в пространственной структуре белков.
1. Элементы вторичной структуры, образованные соседними участками пептидной цепи, обычно соседствуют и в пространственной структуре. Типичны следующие соединения элементов вторичной структуры: аа — две антипараллельно упакованные а-спирали; ßß — два антипараллельных отрезка ß-структуры; ßaß — a-спираль, окруженная двумя отрезками ß-структуры. Такие структуры — единицы свертывания — являются, по существу, первым шагом от вторичной к третичной структуре, на их долю приходится до 2/3 белковой глобулы.
2. Соединения между отрезками периодической вторичной структуры в единицах свертывания типа ßХß, где X — а-спираль или отрезок ß-структуры, почти неизменно являются «правыми», т.е. направлены по часовой стрелке, если смотреть по ходу пептидной цепи.
3. Эти соединения не пересекаются и не образуют узлов пептидной цепи.
Физические основы этих правил не вполне ясны. Возможно, сближение в пространственной структуре соседних элементов пептидной цепи объясняется энтропийными факторами.
При всем многообразии пространственных структур белков удается выделить относительно небольшое число типов укладки полипептидной цепи, причем к одному типу могут принадлежать белки, вовсе не имеющие эволюционного родства. Очевидно, что ограниченность набора типов пространственной структуры диктуется существованием определенных правил, которые управляют свертыванием полипептидной цепи в компактную глобулу.
Выделены следующие главные типы пространственной структуры:
1. а-Спиральные белки, построенные преимущественно из а-спиралей. Простейший структурный мотив в таких белках — пучок четырех a-спиралей, оси которых более или менее параллельны. Именно такую структуру имеют миогемэритрин (рис. 6.6), Н-субъединица ферритина. Типично a-спиральными белками являются глобины.
2. Белки, образованные преимущественно ß-складчатыми слоями. В большинстве таких белков ß-слои наложены под небольшим углом: или ортогональны. Примерами таких белков могут служить пепсин и другие аспартильные протеиназы, супероксиддисмутаза (рис. 6.7), большое семейство белков — переносчиков метаболитов (например, жирных кислот).
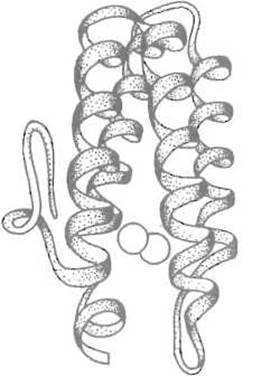
Рис. 6.6. Третичная структура мио- гемэритрина — белка, представляющего собой пучок четырех а-спиралей
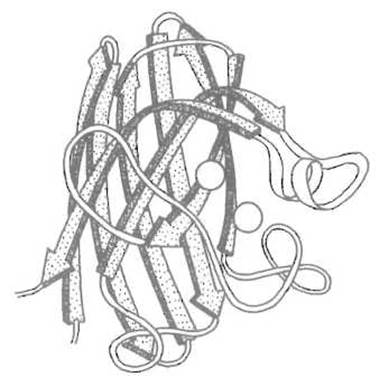
Рис. 6.7. Третичная структура супероксид-дисмутазы — ß-структурного белка. Восемь отрезков ß-структуры соединены поворотами или петлями, есть небольшой участок а-спирали. Кружками показано расположение ионов металлов

Рис. 6.8. Третичная структура триозофосфатизомеразы — типичного a/ß-белка. Характерно чередование восьми отрезков ß-структуры и восьми a-спиралей, экранирующих ß-слой от воды
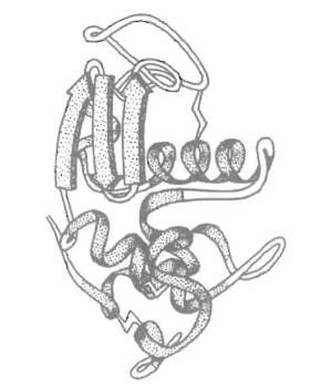
Рис 6.9. Третичная структура лизоцима — a + ß-белка. a-Спиральный и ß-структурный домены (последний — в левой верхней части рисунка) отчетливо разделены
3. а/ß-Белки, в которых а-спирали и отрезки ß-структуры чередуются. Обычно это приводит к формированию центрального ß-складчатого листа, окруженного с обеих сторон а-спиралями, экранирующими его от воды. Этот тип пространственной структуры очень распространен. К нему принадлежат NAD-связывающие домены дегидрогеназ, триозофосфатизомераза (рис. 6.8) и около десятка других белков, структурно близких к этому ферменту.
4. (а + ß) - Белки, в которых а-спирали и отрезки ß-структуры не чередуются, а скорее группируются с себе подобными так, что часть молекулы приобретает пространственную укладку чисто а-спирального типа (тип 1, см. выше), другая — чисто β-типа (тип 2), нередко с элементами (а/ß)-структуры. К этому типу (относится лизоцим куриного яйца (рис. 6.9).