Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Третичная структура белка
Особенности структуры мембранных белков
Сказанное выше справедливо для глобулярных белков, функционирующих в водном окружении, — белков цитозоля и секреторных. Иные закономерности управляют формированием структуры мембранных белков, точнее, интегральных белков, пронизывающих мембрану. Белки, локализованные на поверхности мембраны, содержат специализированный гидрофобный домен, вьполняющий роль якоря, или иную гидрофобную структуру, например ковалентно связанный липидный фрагмент, в остальном же их пространственное строение определяется обычными для всех белков правилами. Интегральные белки, включение которых в мембрану происходит котрансляционно, видимо, вообще не могут удерживать нативную структуру в чисто водном окружении. Они содержат несколько трансмембранных фрагментов, преимущественно образованных отрезками а-спиралей, содержащих гидрофобные аминокислоты. Последние соединяются внемембранными петлями, направленными как в цитозоль, так и во внешнюю среду (рис. 6.10).
Внешние петли в мембранных белках эукариот, как правило, сильно гликозилированы, что усиливает их гидрофильность. Внутримембранные а-спирали могут контактировать друг с другом, образуя пучки; однако внутреннего гидрофобного ядра они не формируют. Отсутствует и фактор, вызывающий его образование, — трансмембранные участки белка контакта с водой не имеют.
Тем большая роль в поддержании единой структуры может принадлежать ван-дер-ваальсовым силам (которые действуют между боковыми цепями аминокислот, образующих а-спирали), электростатическим взаимодействиям погруженных в неполярную среду ионизованных групп и диполей, присущих а-спиралям. Определенную роль могут играть и дисульфидные связи, соединяющие трансмембранные а-спирали. Наконец, внемембранные домены, формируя свою структуру по обычным правилам, могут стабилизировать целостность третичной структуры этих белков, выполняя роль своеобразных организаторов. Трансмембранными могут быть и участки ß-структуры.

Рис. 6.10А. Гипотетическая схема ориентации структурных элементов трансмембранного белка — ß2-адренэргического рецептора в мембране.
Мембрану (заштрихована) пронизывают семь а-спиральных участков, очень богатых гидрофобными аминокислотами. Петли, показанные в верхней части рисунка, выступают во внеклеточное пространство и участвуют в связывании эффектора, в нижней — направлены в цитозоль и обеспечивают взаимодействие с G-белком, передающим сигнал. Зачернены остатки цистеина
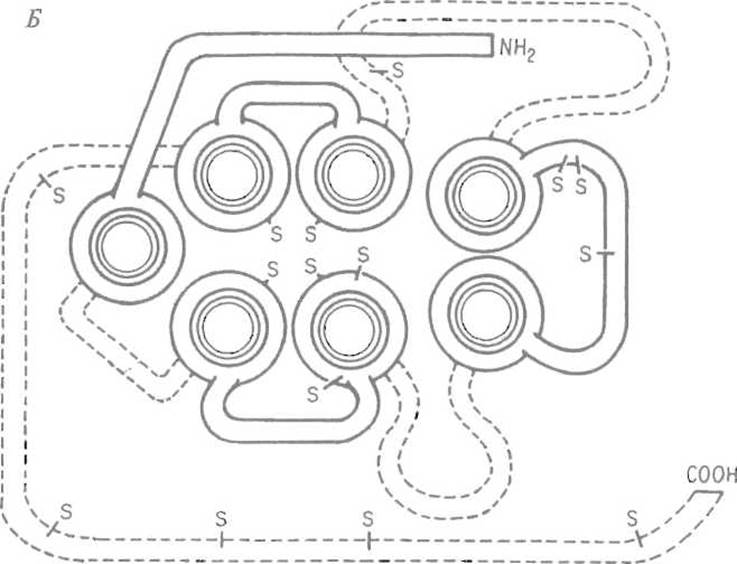
Рис. 6.10Б. Гипотетическая схема ориентации структурных элементов трансмембранного белка — ß2-адренэргического рецептора в мембране.
Та же схема, рассматриваемая со стороны внеклеточного пространства; S обозначает атомы серы цистеина или цистина. Сплошными линиями показаны внеклеточные участки полипептидной цепи, прерывистой — внутриклеточные
Исследование строения трансмембранных белков, которым принадлежат столь важные функции, как транспорт молекул внутрь клетки, межклеточные взаимодействия, образование ионных каналов и передача внешних сигналов в клетку, весьма сложно. В отдельных случаях удастся получить их кристаллы, заменив их естественное окружение — липиды — синтетическим поверхностно-активным веществом. Дальнейшее изучение таких кристаллов идет обычным путем. В более сложных ситуациях прибегают к ограниченному протеолизу, расщепляющему внемембранные участки полипептидной цепи, химической модификации, направленной на эти же участки. Общую укладку элементов вторичной структуры удается наблюдать, используя электронный микроскоп.