Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Третичная структура белка
Денатурация белка
Денатурацией называют существенное изменение вторичной и третичной структуры белка, т.е. нарушение, разупорядочение системы нековалентных взаимодействий, не затрагивающее его ковалентной структуры. Денатурация, как правило, сопровождается утратой белком функциональных свойств, его инактивацией. Однако инактивация сама по себе не может служить надежным критерием денатурации. К денатурации не следует относить конформационные переходы в белке, при которых одна кооперативная система нековалентных взаимодействий перестраивается в другую. Принципиальная разница состоит в том, что в этом случае оба состояния упорядоченны, тогда как характерным признаком денатурации является именно утрата упорядоченности, которая приводит к возрастанию энтропии системы.
Понятие «существенности» изменения пространственной структуры в приведенном выше определении денатурации не поддается количественной оценке. Чаще всего приходится иметь дело с достаточно резким, скачкообразным переходом от нативного состояния к денатурированному, что диктуется кооперативностью третичной структуры белка. Однако встречаются, по-видимому, и случаи, когда белок претерпевает частичную денатурацию, например вследствие утраты пространственной организации одним из образующих его доменов или нарушения системы нековалентных взаимодействий в каком-либо участке супервторичной структуры.
Качественное рассмотрение показывает, что денатурация белка может быть вызвана действием ряда факторов. Так, повышение температуры приводит к возрастанию вклада энтропийного фактора, что обусловливает тепловую денатурацию, происходящую, как правило, скачкообразно. Температура денатурации белков весьма различна и существенно зависит от других условий, например, многие белки заметно стабилизируются ионами кальция. Некоторые белки отличаются термостабильностью. Это особенно свойственно белкам термофильных организмов, адаптировавшихся к жизни при повышенных температурах. Например, протеолитический фермент термолизин, секретируемый термофильными бациллами, сохраняет активность до 80°С.
Денатурации способствует воздействие на белок реагентов, нарушающих нековалентные взаимодействия, прежде всего систему водородных связей. Как уже отмечалось, стабильность пространственной структуры белка требует образования не менее 90% возможных водородных связей внутри белковой глобулы. Понятно, что разрыв значительной их части вызовет кооперативный переход нативной структуры в денатурированное состояние. Чаще всего для денатурации белка применяют концентрированные (6-8 М) растворы мочевины. Молекула мочевины как бы имитирует пептидную связь и способна выступать и как донор, и как акцептор водородных связей, конкурируя с пептидными группировками и другими функциональными группами белка, образующими в нативной структуре внутримолекулярные водородные связи:
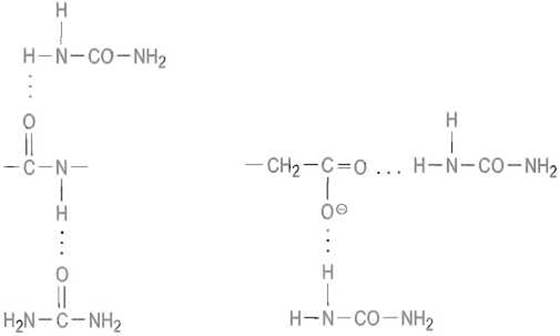
Денатурация белка при увеличении содержания мочевины в растворе происходит скачком, как правило, в небольшом интервале ее концентрации. Например, денатурация лизоцима наблюдается при переходе от 3,2 к 4,0 М раствору мочевины. Заметим, что денатурирующее действие высоких концентраций мочевины может быть связано и с нарушением структуры воды опять-таки за счет образования ею водородных связей с молекулами мочевины. Это должно привести к резкому ослаблению стабилизирующей роли гидрофобных контактов.
Еще более сильным денатурирующим агентом является солянокислый гуанидин (обычно 6 М раствор)

В этом случае действуют те же факторы, что и при использовании мочевины: конкуренция с пептидными и функциональными группами белка за водородные связи и нарушение структуры воды. В дополнение к ним сказывается и очень высокая ионная сила — гуанидин является очень сильным основанием и практически всегда полностью протонирован, поэтому в концентрированных его растворах исключаются внутрибелковые электростатические взаимодействия и, следовательно, устраняется еще один из факторов, способных стабилизировать пространственную структуру.
Денатурирующим действием на белки обладают и органические растворители. Они способны устанавливать контакты с гидрофобными аминокислотными остатками белка, лишая гидрофобное ядро его стабилизирующей роли. Одновременно многие растворители, например спирты, формамид, муравьиная кислота, как бы переключают на себя водородные связи, поддерживающие третичную структуру. С дальнейшим повышением концентрации растворителя может нарушиться и структура воды, что устранит фактор, от которого зависит формирование внутримолекулярных гидрофобных контактов в белковой глобуле.
Денатурирующее действие органических растворителей весьма индивидуально и зависит от природы растворителя, белка, других условий (например, температуры). Учет этих факторов позволяет в ряде случаев избежать денатурации и применять органические растворители при фракционировании белков, их хроматографии, а иногда и проводить реакции с участием ферментов в органических растворителях. В таких случаях, по-видимому, важно, чтобы белок сохранял те молекулы воды, которые связаны водородными связями с функциональными группами на его поверхности, т.е. гидратную оболочку. Известны и белки, легко переносящие высокие концентрации органических растворителей.
Эффективными денатурирующими агентами являются ионные детергенты, среди которых особенно часто используют анионный детергент — додецилсульфат натрия: СH3—(СН2)11—OSO-3Na+.
Его длинная гидрофобная цепь образует контакты с гидрофобными остатками белка, что при концентрации детергента около 0,5 мМ приводит к полному развертыванию третичной структуры. Взаимное отталкивание практически всегда отрицательно заряженных сульфатных групп влечет за собой вытягивание комплекса додецилсульфат — белок в палочковидную структуру, несущую столь большое число отрицательных зарядов додецилсулъфата, что вклад собственных ионных групп белка оказывается, как правило (но не всегда!), малосущественным. Такой способ денатурации нашел широкое применение при электрофоретических исследованиях белков в полиакриламидном геле.
Как и при действии других денатурирующих агентов, развертывание белка в присутствии додецилсульфата происходит скачкообразно. Например, бактериальная рибонуклеаза — барназа — при 0,65 мМ детергента и 37°С связывает сразу 14 молекул додецилсульфата на одну молекулу белка, состоящую из 110 аминокислотных остатков. При меньших концентрациях реагента белок сохраняет стабильность и комплекс с детергентом практически не образует.
Подвижность отрицательно заряженных комплексов додецилсульфат — белок в силу примерно одинаковой плотности заряда (как правило, связывается практически постоянное количество додецилсульфата: примерно 0,4 г на 1 г белка), а также одинаковой (палочковидной) формы комплексов определяется только длиной полипептидной цепи. Это сделало электрофорез в присутствии додецилсульфата наиболее распространенным способом определения молекулярной массы полипептидных цепей. Сказанное справедливо, если в белке нет дисульфидных связей, которые не позволят цепи развернуться в линейную структуру. Ввиду этого денатурацию додецилсульфатом натрия обычно дополняют восстановлением дисульфидных связей меркаптоэтанолом или дитиоэритритом. Иногда обработку детергентом ведут при 100°С, добавляя в смесь концентрированную мочевину, с тем чтобы обеспечить наиболее полную денатурацию белка.
Денатурация белка может происходить и при экстремальных значениях pH. Так, в сильнокислых растворах полностью протонируются отрицательно заряженные карбоксильные группы остатков глутаминовой и аспарагиновой кислот. Это приводит к тому, что на поверхности белка сохраняются только положительные заряды катионных групп, взаимное отталкивание которых приводит к развертыванию глобулы, одновременно протоны разрывают ряд водородных связей. В щелочных растворах (при pH 11 и выше) утрачивают положительные заряды аминогруппы лизина и приобретают отрицательные — фенольные группы тирозина, что опять-таки ведет к резкому преобладанию отрицательных зарядов и развертыванию глобулы. Этому же способствует и разрыв ряда водородных связей, в том числе образованных водородом фенольных групп тирозина. Известны, однако, белки, адаптированные, например, к высокой кислотности. Так, пепсин сохраняет свою структуру и активность при pH 1-2. Этому, видимо, благоприятствует почти полное отсутствие катионных групп в этом белке.
Установить полноту денатурации, т.е. полное исчезновение системы нековалентных взаимодействий, свойственных нативной структуре, довольно трудно. Обычно ограничиваются тем, что наблюдают за изменением какого-либо характерного для пространственной структуры белка физического параметра, например дисперсии оптического вращения или спектра флуоресценции, при углублении условий денатурации — повышении концентрации мочевины, росте температуры и т.п. Полагают, что денатурация завершилась, если наблюдаемый параметр достигает некоторого предельного значения, например, если спектр флуоресценции перестает изменяться, достигнув формы, характерной для белка, в котором все остатки триптофана и тирозина равно доступны растворителю. Разумеется, это не дает полной гарантии исчезновения всех нековалентных контактов, однако можно надеяться на отсутствие протяженных элементов третичной структуры, сохраняющих кооперативность.
Денатурация белка нередко осложняется повреждением его ковалентной структуры. Так, продолжительное действие мочевины при повышенной температуре может сопровождаться карбамилированием аминогрупп лизина:
![]()
(В действительности реакция, видимо, протекает с участием циановой кислоты HNCO, находящейся в равновесии с мочевиной.)
Довольно часто наблюдается гидролиз амидных групп аспарагина и глутамина (дезамидирование), в особенности если в белке есть последовательность Asn—Gly. К целому ряду повреждений, в том числе к расщеплению остатков цистина с образованием дегидроаланина, ведет щелочная обработка белков. Все эти факторы следует контролировать, что становится критически важным, если имеется в виду ренатурация белка — перевод денатурированного белка в нативное состояние.