Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Третичная структура белка
Ренатурация белка
Денатурацию белка в определенных условиях in vitro удается обратить, перейдя от развернутой полипептидной цепи к компактной глобуле, имеющей вполне определенную пространственную структуру. Этот процесс, называемый ренатурацией, моделирует, хотя и не в полной мере, свертывание полипептидной цепи в глобулу в ходе трансляции при биосинтезе белка.
Как известно, пространственная структура белка определяется его первичной структурой. Известное соотношение один ген — один белок в сущности эквивалентно утверждению, что генетически детерминированной последовательности аминокислот достаточно для того, чтобы однозначно предопределить ее свертывание в свойственную тому или иному белку третичную структуру. Разумеется, в общем случае такое заключение справедливо лишь для условий, близких к существующим в данной клетке при биосинтезе данного белка, которые могут включать в себя определенный диапазон pH, присутствие некоторых ионов, например ионов кальция, а также кофакторов, присущих этому белку, например коферментов, гема и т.п.
При соблюдении указанных условий будет достигнуто рассмотренное выше соотношение факторов, от которого зависит стабильность белковой глобулы, т.е. создадутся термодинамические предпосылки формирования нативной структуры — ренатурации белка.
Это положение было подтверждено успешными опытами по ренатурации белков in vitro, проведенными впервые К. Анфинсёном и сотрудниками в 1960-х гг., на панкреатической рибонуклеазо и лизоциме, а затем и на ряде других объектов.
Многие белки, в том числе обладающие внутримолекулярными дисульфидными связями, полностью денатурируют в присутствии высоких концентраций мочевины или солянокислого гуанидина с одновременным расщеплением дисульфидных связей восстанавливающими агентами (меркаптоэтанолом, меркаптоуксусной кислотой или дитиоэритритом). Это, естественно, сопровождается их полной инактивацией.
При медленном удалении денатурирующего агента и восстановителе; (например, диализом или гель-фильтрацией) происходят формирование нативной структуры, замыкание дисульфидных связей (для чего часто достаточно окисления кислородом воздуха) и полное восстановление активности белка. В специальных, опытах была подтверждена правильность образования дисульфидных связей, что свидетельствует, в дополнение к реактивации, о восстановлении нативной структуры. На примере одного из белков — лизоцима — этот вывод был прямо подтвержден методом рентгеноструктурного анализа. Табл. 6.4 иллюстрирует эффективность ренатурации ряда белков.
Может показаться, что вывод о предопределенности пространственной структуры последовательностью аминокислот, подтверждаемый указанными выше опытами, не вполне строг. Дело в том, что экспериментальное доказательство полноты разрушения всех нековалентных взаимодействий при денатурации белка затруднено, поэтому нельзя исключить сохранения какой-то части ядра нативной структуры. Этот довод опровергается, однако, тем, что целый ряд (правда, небольших) белков удалось получить химическим синтезом их полипептидных цепей из производных аминокислот. Такие пептидные цепи неизменно давали при ренатурации хороший выход активного (и, значит, нативного) белка (см. гл. 2).
Таблица 6.4 Ренатурация белков, денатурированных обработкой 8 М мочевиной или 6 М солянокислым гуанидином с одновременным восстановлением дисульфидных связей
|
Белок |
Молекулярная масса, Да |
Число S—S связей |
Выход, % |
|
|
теоретический* |
достигнутый |
|||
|
Рибонуклеаза |
18 000 |
4 |
1 |
95 |
|
Лизоцим |
12 000 |
4 |
1 |
50-80 |
|
Такаамилаза** |
40 000 |
4 + SH |
0,3 |
48 |
|
Трипеиноген |
25 000 |
4 |
1 |
60 |
|
Пепсиноген |
38 000 |
3 |
6,7 |
50 |
|
Сывороточный альбумин |
65 000 |
17 |
— |
50 |
* Теоретический выход рассчитан в предположении, что дисульфидные связи образуются случайно.
** а-Амилаза Aspergillus oryzae.
Несмотря на успешное образование нативной структуры, ренатурация белков in vitro протекает весьма медленно, что не соответствует высокой скорости свертывания третичной структуры в физиологических условиях. По-видимому, наиболее существенна трудность выбора оптимального, кинетически выгодного пути перехода от развернутой полипептидной цепи к компактной пространственной структуре. Число всех возможных способов свертывания достаточно длинной полипептидной цепи настолько велико (среди них окажется множество непродуктивных, тупиковых), что переход к правильной структуре простым перебором различных конформаций потребовал бы огромного времени.
Реальное свертывание белка, очевидно, происходит по одному или, во всяком случае, немногим путям, что резко сокращает время формирования нативной структуры. Свертывание полипептидной цепи in vivo по необходимости синхронизировано с ее биосинтезом, что уже открывает возможность выбора определенного пути, так как формирование пространственной структуры может происходить котрансляционно. Более того, при свертывании белка в физиологических условиях может быть существенной та конформация, в которой полипептидная цепь покидает пептидилтрансферазный центр рибосомы, и даже темп образования цепи — есть данные о задержках трансляции на участках цепи, являющихся границами между элементами вторичной структуры.
Понятно, что при ренатурации белка in vitro оба указанных фактора работать не могут и она (хотя и в этом случае протекает не случайным образом, а по ограниченному числу путей) требует для поиска этих путей гораздо более значительного времени, чем in vivo.
Существование определенного пути свертывания полипептидной цепи, считавшееся до недавнего времени весьма вероятной гипотезой, подтверждает ряд экспериментальных фактов. Так, дисульфидные связи в панкреатическом ингибиторе трипсина и рибонуклеазе замыкаются в определенном порядке, причем не обязательно сразу происходит образование «правильных» связей, т.е. тех, которые существуют в конечной форме — нативном белке. Иногда наблюдается временное образование дисульфидной связи между остатками цистеина, которые, видимо, сближаются в промежуточном соединении. Впоследствии такая дисульфидная связь вступает в реакцию обмена с другими, еще не окисленными остатками цистеина и расщепляется, уступая место связям, характерным для нативной конформации.
Применение метода направленного мутагенеза (белковой инженерии) показало, что наряду с аминокислотными остатками, критически важными для формирования устойчивой пространственной структуры белка, встречаются и такие, замена которых иными не сказывается на стабильности белковой глобулы, но серьезно влияет на кинетику свертывания полипептидной цепи. Следовательно, эти аминокислотные остатки важны для возникновения промежуточных структур на пути к нативной, устойчивой глобуле.
Так, при свертывании а-субъединицы триптофансинтетазы (рис. 6.11) наблюдается промежуточная ступень, на которой крупный N-концевой домен (содержащий аминокислотные остатки 1-188 и образованный шестью отрезками параллельной ß-структуры и пятью а-спиралями) уже свернут, тогда как С-концевой фрагмент (начинающийся со 189-го остатка и формирующий в нативном белке два отрезка ß-структуры и три а-спирали; всего 80 аминокислотных остатков) еще денатурирован, неупорядочен. Заметим, что в этом белке нет пространственно отграниченных, доменов — его структура достаточно компактна, речь идет о доменах как промежуточных формах свертывания а-субъединицы.
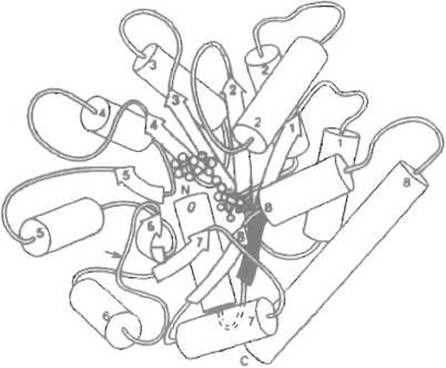
Рис. 6.11. Третичная структура а-субъединицы триптофан-синтетазы.
Образована, как и триозофосфат-изомераза, чередующимися а-спиралями (цилиндры) и отрезками ß-структуры (стрелки). Маленькими кружками в центре показано место связывания ингибитора. Стрелкой обозначена граница между N- и С-концевыми доменами, в этом районе по остатку Arg-188 происходит гидролиз трипсином, который приводит к разделению доменов. Номера указывают порядок расположения элементов вторичной структуры
Среди мутантов этого фермента были отобраны такие, которые затрагивают контакты между N- и С-концевым доменами. Phe-22 N-концевого домена, контактирующий с 8-м ß-структурным отрезком в С-концевом домене, был заменен на Leu. При этом замедлились скорости денатурации и ренатурации, но не была затронута стабильность белка. Очевидно, что это обусловлено понижением стабильности переходного состояния при свертывании. Замена Gly-234 в С-концевом домене на аспарагиновую кислоту замедлила развертывание в большей мере, чем свертывание. Поскольку первый и восьмой ß-структурные отрезки, в которые включены соответственно фенилаланин и глицин, сближены в третичной структуре свернутой субъединицы, их взаимное «причаливание играет, по-видимому, важную роль в формировании промежуточного продукта свертывания, ускоряя процесс ренатурации.
Исследование кинетики ренатурации ряда белков позволяет в первом приближении так описать этот процесс. Сначала быстро образуются короткие отрезки вторичной структуры — а-спирали, ß-листы, ß-изгибы. Понятно, что каждый такой участок сам по себе, до образования компактной глобулы, недостаточно стабилен, поэтому соответствующие элементы вторичной структуры то возникают, то распадаются, «мерцают» (рис. 6.12).
Затем такие участки относительно организованной структуры, составляющие в совокупности фрагмент полипептидной цепи из 50-150 аминокислот (будущий домен белка), как бы «схлопываются» за счет нековалентных взаимодействий. При этом образуется так называемая расплавленная глобула, которая в целом близка к нативной пространственной структуре и отличается от нее меньшей компактностью и иным размещением боковых цепей аминокислотных остатков. Далее происходит уточнение структуры на уровне доменов, после чего устанавливается контакт между последними. Этими относительно медленно протекающими стадиями завершается формирование белковой глобулы, и она приобретает активность.
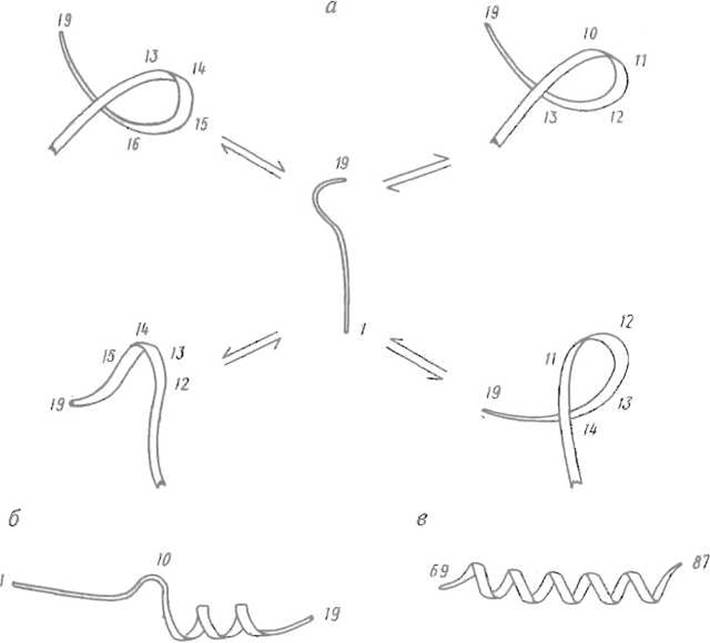
Рис. 6.12. Конформационные состояния фрагмента 69-87, соответствующего С-концевой а-спирали миогемэритрина (по данным ЯМР).
а — набор неустойчивых конформаций, которые пептид принимает в воде; б — преимущественная конформация пептида в менее полярной среде (смесь вода-трифторэтанол), при кото рой С-концевая часть образует а-спираль, в — конформация пептида в компактной структуре миогемэритрина — а-спираль охватывает всю последовательность; цифрами обозначены номера остатков в пептиде (а, б) и соответствующем фрагменте миогемэритрина (в)
В свете обсужденных данных о ренатурации белков in vitro очевидно, что свертывание белка, предопределенное его первичной структурой, может быть во многих случаях воспроизведено с достаточно хорошим выходом. Помимо рассмотренных выше кинетических ограничений следует учитывать и то, что in vivo пространственная структура в норме формируется каждой вновь синтезируемой молекулой в отдельности, без накопления развернутых, денатурированных структур.
Роль последнего фактора стала особенно очевидной при сверхсинтезе чужеродных белков в микробных клетках. В таких системах нередко наблюдается накопление внутри клеток-продуцентов так называемых тел включения, которые представляют собой агрегаты денатурированных пептидных цепей. Если белок содержит дисульфидные связи, в таком агрегате они образуются беспорядочно, во многих случаях межмолекулярно. Возникновение агрегатов можно объяснить тем, что при интенсивно протекающем сверхсинтезе одновременно на многих рибосомах образуются лишенные структуры пептидные цепи, появление которых значительно опережает процесс свертывания. Как следствие, молекула не успевает «перебрать» промежуточные конформации и найти путь свертывания. Вместо этого она агрегирует с соседними, также еще не свернутыми полипептидными цепями.
Как правило, отделение тел включения от других компонентов клетки проходит без затруднений, что облегчает их очистку. Однако в дальнейшем возникает непростая проблема ренатурации полученного белка, для которой во многих случаях так и не удается отыскать удовлетворительное решение. Обычный прием состоит в том, что агрегированный белок сначала переводят в раствор и добиваются полного разрушения агрегатов, применяя концентрированные мочевину или солянокислый гуанидин в присутствии соединений, восстанавливающих дисульфидные связи (например, меркаптоэтанола). Затем прибегают к более или менее плавному удалению денатурирующего реагента и восстановителя, создавая условия постепенной ренатурации белка, причем поддерживают низкую концентрацию последнего. Для образования дисульфидных связей применяют мягко действующую окислительно-восстановительную систему, например смесь 10 мМ окисленного и 1 мМ восстановленного глутатиона. В ряде случаев такой прием дает хорошие результаты: так, практически количественно проходит ренатурация интерлейкина-2, полипептидная цепь которого состоит из 133 аминокислот и содержит одну дисульфидную связь и один «непарный» остаток цистеина.
Ренатурация мембранных белков представляет собой отдельную задачу. Трансмембранный белок — бактериородопсин — после его экстракции из мембраны и хроматографической очистки в смеси органических растворителей удалось ренатурировать, поместив в смесь фосфолипида и поверхностно-активного соединения. Очевидно, что и в этом случае самосборка белка в присутствии липида приводит от денатурированной молекулы к структуре, свернутой так же, как нативный белок.
Таким образом, ренатурация белка принципиально возможна и во многих случаях практически осуществима, однако ряд препятствий, преимущественно кинетических, может серьезно затруднить, а иногда полностью остановить этот процесс. Необходимо подчеркнуть, что способность полипептидной цепи белка самопроизвольно образовывать пространственную структуру еще не означает, что в реальных условиях биосинтеза этот процесс протекает без участия внешних факторов, в том числе ряда белков, выступающих катализаторами свертывания полипептидной цепи.
Одной из причин замедленного формирования пространственной структуры белка in vivo могла быть задержка в образовании дисульфидных связей. Существует так называемый перегруппировывающий фермент — протеиндисулъфидизомераза, — ускоряющий перебор возможных дисульфидных связей и тем самым поиск правильно образованных. В его присутствии ренатурация протекает гораздо быстрее. Так, 70%-я ренатурация панкреатической рибонуклеазы при действии этого фермента, выделенного из печени, происходит уже за 30 мин, тогда как спонтанная реактивация за это время так мала, что еще не обнаруживается.
Протеиндисульфидизомераза в эукариотических клетках содержится в эндоплазматическом ретикулуме и является димерным белком, каждая из субъединиц которого содержит два домена, структурно близких тиоредоксину, небольшому белку, участвующему в окислительно-восстановительных процессах. Каждый из этих доменов, видимо, и содержит каталитический центр, в котором имеется группировка из двух остатков цистеина (восстановленная форма), способных расщеплять дисульфидную связь в белке-субстрате, образуя за этот счет собственную дисульфидную связь (окисленная форма). В свою очередь окисленная форма протеиндисульфидизомеразы, реагируя со свободными SH-гpyппaми цистеина в субстрате, вызывает образование в этом белке дисульфидной связи, чем и обусловлен быстрый перебор в нем всех возможных дисульфидных мостиков:
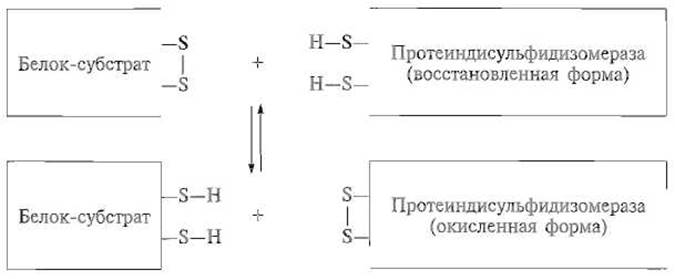
Видимо, такую же роль может играть и сам тиоредоксин, причем in vivo катализируемый этими ферментами дисульфидный обмен сочетается с образованием все большего числа дисульфидных связей в белке-субстрате за счет действия системы восстановленный глутатион — окисленный глутатион по схеме

В ряде случаев медленной стадией, лимитирующей скорость ренатурации белка, оказывается цис-, транс-изомеризация отдельных пептидных связей, прежде всего образованных иминогруппой пролина. Как уже отмечалось при обсуждении вторичной структуры (см. гл. 5), разница в энергии таких цис- и транс-пептидных связей невелика, поэтому переход одного изомера в другой при денатурации белка вполне вероятен. Обратный переход из цис-формы, как правило, неблагоприятной для свертывания, в транс-форму - ту, в которой и существует подавляющее большинство пептидных связей в белке, также требует определенной энергии активации. Ввиду этого молекула, еще не завершившая образования пространственной структуры, вынуждена как бы «дожидаться» благоприятной изомеризации пептидной связи пролина.
Существует весьма распространенный фермент — пролил-цис-, транс-изомераза (в эукариотических клетках это циклофилин, способный специфически связывать антибиотик — иммунодепрессант циклоспорин). Он катализирует цис-, транс-изомеризацию пептидных связей пролина и тем ускоряет свертывание цепи в компактную структуру.
Заметим, что два упомянутых фермента, катализирующие ренатурацию белка, все же далеко не обеспечивают тех скоростей свертывания полипептидной цепи, которые соответствовали бы скорости трансляции. Установлено, что при формировании пространственной структуры белка in vivo полипептидная цепь не предоставлена сама себе, а взаимодействует с целым рядом специализированных белков, получивших название шаперонов, функция которых — обеспечить быстрое нахождение правильной пространственной структуры.
Известен ряд семейств шаперонов, которых особенно много среди так называемых белков теплового шока. Последние названы так, потому что они синтезируются клетками в больших количествах в ответ на воздействия, неблагоприятные для эффективного свертывания третичной структуры белков, в частности на повышение температуры. Однако они образуются и действуют и в нормальных условиях.
Одно из семейств шаперонов составляют так называемые стресс-белки 70 эукариотических клеток, имеющие молекулярную массу около 70 кДа. Они образуют комплексы с еще не завершившими свертывание полипептидными цепями, предотвращая их взаимодействие между собой и нежелательную агрегацию. Эти белки состоят из двух взаимодействующих между собой доменов. Один из доменов образует комплекс с участками развернутой полипептидной цепи, другой — связывает АТФ и способен расщеплять его, являясь медленно действующей АТФазой. При гидролизе АТФ белок переходит в другое конформационное состояние и его комплекс с полипептидной цепью распадается.
Полипептидные цепи белков, которые подлежат транспорту из цитоплазмы, за счет образования комплексов со стресс-белками 70 удерживаются в развернутом, наиболее приспособленном для переноса через мембрану состоянии. Продолжительность жизни таких комплексов задается, по-видимому, временем, требующимся для внутримолекулярного гидролиза АТФ, связанного стресс-белками 70 (ср. гл. 12). Пока не ясно, катализируют ли эти белки непосредственно само образование вторичной или третичной структуры. Не исключено, что их роль ограничивается предотвращением нежелательных для этого процесса межмолекулярных взаимодействий, агрегации еще не свернутых полипептидных цепей.
Еще одну группу широко распространенных белков, вовлеченных в формирование третичной структуры, составляют так называемые шаперонины — белки, кодируемые генами GroEL и GroES у Е.соRI Белки GroEL образованы субъединицами с молекулярной массой около 60 кДа, которые формируют своеобразную четвертичную структуру, построенную из двух лежащих одно на другом колец по семь субъединиц в каждом. Предполагают, что частично свернутая полипептидная цепь располагается на поверхности такого кольца. Отдельные ее участки, связанные субъединицами шаперонина с различной прочностью, могут высвобождаться из комплекса и формировать свойственную им вторичную структуру, не встречая помех со стороны соседних участков или других полипептидных цепей, удерживаемых в связанном состоянии. В таких условиях формирование регулярных элементов вторичной структуры происходит как бы поочередно. По завершении этого процесса комплекс распадается, что зависит, как и в рассмотренном выше случае, от расщепления АТФ, связанного GroEL-белком. Белки GroES с молекулярной массой 10 кДа ассоциируют с белком GroEL и каким-то образом регулируют его АТФазную активность и, значит, время жизни комплекса.