Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Четвертичная структура белка
Способы исследования четвертичной структуры
Наибольшую информацию о четвертичной структуре белка дает метод рентгеноструктурного анализа, однако он применим, как правило, на завершающих этапах исследования. Между тем хотя бы приближенные сведения об этом уровне организации необходимы с самого начала. Соответственно особое значение имеют способы мягкой диссоциации четвертичной структуры, позволяющие выделить субъединицы или какие-то промежуточные структуры в нативном состоянии. Общего решения такой задачи нет, так как прочность четвертичной структуры может быть весьма различной. Однако представления о характере сил, которые обусловливают стабильность четвертичной структуры, помогают в поиске условий, благоприятствующих диссоциации межсубъединичных контактов.
Так, молекула гемоглобина, образованная из четырех субъединиц и имеющая формулу а2ß2, уже в 0,5 М NaCl диссоциирует на примеры по схеме a2ß2 → 2aß, что указывает на весьма слабые связи между одноименными субъединицами. В других случаях удается добиться диссоциации четвертичной структуры в присутствии умеренных концентраций мочевины или солянокислого гуанидина — реагентов, вызывающих расщепление межсубъединичных водородных связей, а также гидрофобных контактов. Довольно хорошие результаты дает исчерпывающая модификация аминогрупп лизина ангидридами дикарбоновых кислот, например янтарным ангидридом:
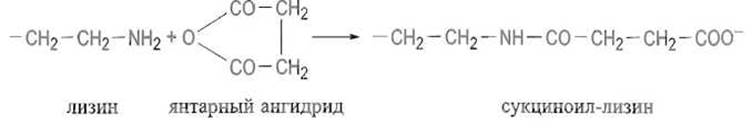
В результате такой реакции, затрагивающей практически только ε-аминные группы остатков лизина, которые в нормальных условиях полностью протонированы и несут положительный заряд, последние заменяются отрицательно заряженными карбоксилат-ионами сукциноильных группировок. Происходит резкое изменение поверхностного заряда белковой глобулы (в данном случае субъединицы). Появление на контактирующих поверхностях субъединиц одноименных отрицательно заряженных групп резко ослабляет взаимодействие между ними и приводит к диссоциации четвертичной структуры. Определение молекулярной массы диссоциированных субъединиц, как и исходного белка, проводят методом седиментационного анализа или чаще гель-фильтрацией.
Впрочем, при первичной характеристике белка обычно прибегают к жесткой денатурации молекулы, разрушению в ней всех нековалентных взаимодействий, что вызывает, естественно, и полную утрату четвертичной структуры. Излюбленный прием состоит в обработке белка анионным детергентом — додецилсульфатом натрия. Как уже отмечалось в разд. 6.10, этот детергент прочно связывается с гидрофобными элементами полипептидной цепи и вызывает ее полное развертывание в палочковидную структуру, заряженную отрицательно, причем количество связавшегося додецилсульфата в расчете на единицу длины полипептидной цепи, а значит, и плотность отрицательного заряда весьма постоянны. Ввиду этого электрофоретическая подвижность таких комплексов зависит только от длины цепи, что дает возможность выяснить, состоит ли изучаемый белок из одного или нескольких видов субъединиц, отличающихся по молекулярной массе. Сравнение же электрофоретических подвижностей субъединиц и набора стандартных белков с известными молекулярными массами позволяет определить и молекулярные массы субъединиц.
Заметим, что проведение электрофореза комплексов белок — додецилсульфат в свободном растворе невозможно, так как зоны разделяемых компонентов будут перемешиваться из-за неизбежной конвекции. Чтобы снизить этот эффект, электрофорез проводят в гелях полиакриламида, поперечносшитого метилен-бисакриламидом. Полимерная сетка, плотность которой определяется концентрацией взятого для приготовления геля акриламида и сшивающего компонента, создает препятствия для перемещения к аноду отрицательно заряженных комплексов тем большие, чем больше длина пептидной цепи Регулируя плотность геля, можно подобрать оптимальные условия для определения той или иной величины молекулярной массы. Точность метода вполне удовлетворительна для анализа четвертичной структуры.
Для определения стехиометрии четвертичной структуры требуется знать, из скольких видов субъединиц построен белок и какова их молекулярная масса. Если при этом известна молекулярная масса нативного белка, можно сделать определенные предположения о его четвертичной структуре. Несколько сложнее обстоит дело при изучении белков, имеющих разные субъединицы одинаковой или очень близкой молекулярной массы. В таких случаях используют определение N-концевых аминокислот или последовательностей, которые могут оказаться характерными для каждой из субъединиц, или же прибегают к поиску способа диссоциации белка на субъединицы, сохранившие третичную структуру, что позволяет разделить их каким-либо из хроматографических методов.