Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Четвертичная структура белка
Функциональное значение четвертичной структуры белка
Подробный анализ функциональной роли четвертичной структуры может быть дан только на примере конкретных белков, что выходит за рамки данной главы. Мы остановимся поэтому только на некоторых принципиальных положениях. Нередко утверждалось, что построение крупных белковых молекул из не очень длинных пептидных цепей, образующих четвертичную структуру, позволяет снизить опасность ошибок трансляции. Действительно, даже одна ошибка в биосинтезе достаточно длинной полипептидной цепи, состоящей, например, из 1000 аминокислотных остатков, может дестабилизировать его структуру и сделать весь синтез бессмысленным. В том случае, если белок такого же размера был бы построен, например, из четырех субъединиц по 250 аминокислотных остатков каждая, такая же ошибка вызовет потерю только одной субъединицы.
Эти соображения, видимо, несправедливы, поскольку, как выяснилось в последнее время, многие белки синтезируются в виде очень длинных (по нескольку тысяч аминокислотных остатков) предшественников, так называемых полибелков, в дальнейшем нарезаемых на функциональные глобулы. Следовательно, ошибки трансляции не накладывают серьезных ограничений на размер пептидной цепи, поэтому трудно представить, чтобы четвертичная структура развилась как способ защиты от них.
Можно предположить, что четвертичная структура способна выполнять одну или несколько следующих функций.
1. Объединение нескольких взаимосвязанных функций в единой структуре. Эта особенность четвертичной структуры лежит в основе пространственной организации, совмещения в единой структуре нескольких функционально активных центров, каждый из которых размещается на отдельной субъединице, — такова, например, РНК-полимераза. Иногда по сходным принципам, но гораздо более сложно организуются очень крупные полиферментные комплексы.
2. Архитектурная функция. Четвертичная структура позволяет формировать из сравнительно небольших глобулярных субъединиц пространственные образования весьма сложной конфигурации, обеспечивающие специфические функциональные возможности белка.
Так, у ферритина (белок животных) молекула построена из 24 субъединиц, окружающих большую внутреннюю полость. Эта полость предназначена для хранения оксида железа — в ней размещается до 3500 группировок FeO.OH (рис. 7.3) Еще один пример такой же функции — формирование двумя субъединицами небольшого белка утероглобина полости размером 15х7х8Å, которая служит для связывания стероидного гормона — прогестерона. Субъединицы фермента триптофансинтетазы E.coli катализируют реакции:
✵ а -реакция обеспечивается а-субъединицей: индол-3-глицерофосфат → индол + D-глицеральдегид-3-фосфат;
✵ β-реакция обеспечивается димером ß-субъединиц L-серин + индол → L-триптофан + Н2O.
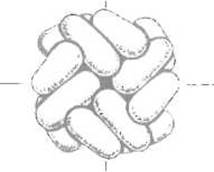
Рис. 7.3. Четвертичная структура ферритина. Ферритин — гетерополимерный белок, построенный из 24 структурно близких легкой и тяжелой субъединиц. Молекула представляет собой полую сферическую оболочку, пронизанную каналами, через которые внутрь поступают ионы железа. По-видимому, субъединицы в ходе формирования четвертичной структуры последовательно объединяются в димеры, тетрамеры, гексамеры, октамеры
Объединение а- и ß-субъединиц в четвертичную структуру а2ß2 открывает возможность проводить суммарную a, ß-реакцию:
L-серин + индол-3-глицерофосфат → L-триптофан + D-глицеральдегид-3-фосфат.
Существенно, что продукт первой реакции — индол — служит субстратом второй, которая протекает с участием другого каталитического центра. Четвертичная структура этого фермента, который можно рассматривать как прообраз полиферментных комплексов, построена так, что субъединицы образуют своего рода туннель, по которому индол перемещается от одного центра к другому, не переходя в раствор. Этим обеспечивается высокая эффективность суммарного процесса, приводящего к синтезу триптофана. Очевидно, что в рассмотренном случае реализуется и принцип объединения функций в единой структуре.
По-видимому, некоторые белки, которые соединяют в единой структуре две взаимосвязанные функции, могли проходить в своей эволюции стадию формирования четвертичной структуры из двух самостоятельных субъединиц. В дальнейшем произошло слияние их структурных генов и, следовательно, объединение полипептидных цепей в одну. В результате, как можно предполагать, субъединицы как бы перешли в ранг доменов в единой молекуле.
Заложенные в четвертичной структуре возможности используются и при создании функциональных центров белков. Так, активные центры ряда дегидрогеназ формируются аминокислотными остатками, расположенными на разных субъединицах этих ферментов. Это позволяет организовать активный центр, охватывающий субстрат со многих сторон, изолировать его от воды. Например, в алкогольдегидрогеназе лошади «карман», в котором находится активный центр, образован боковыми цепями аминокислот, принадлежащих двум одинаковым субъединицам. Субъединица 1 дает для этого три остатка лейцина, по два — серина и фенилаланина, по одному — валина, изолейцина, пролина и треонина. Субъединица 2 — остатки метионина, лейцина и серина.
В триозофосфатизомеразе зона связывания субстрата также образована двумя субъединицами, которые при взаимодействии с фосфатной группой субстрата сближаются, закрывая его от окружающего растворителя, так что реакция протекает при полном его отсутствии. Центр связывания антигена иммуноглобулином образован аминокислотными остатками, расположенными на двух полипептидных цепях иммуноглобулина — легкой и тяжелой.
3. Обеспечение множественных взаимодействий белка с протяженными структурами. За счет образования четвертичной структуры два или несколько функциональных центров белка могут объединяться в одном крупном образовании и устанавливать кооперативное взаимодействие с какими-либо протяженными биологическими молекулами. Например, за счет существования четвертичной структуры иммуноглобулины типа G объединяют в одной молекуле два идентичных центра связывания антигена, позволяя в то же время в известных пределах изменять расстояние между ними за счет конформационной гибкости. Кооперативность взаимодействия таких антигенсвязывающих центров с макромолекулярными антигенами, например бактериальными стенками, делает комплексы антиген—иммуноглобулин гораздо более прочными, чем это наблюдалось бы для мономерного белка.
Не менее важно существование большого семейства ДНК-связывающих белков в виде димеров, содержащих опять-таки два идентичных участка связывания. Такие белки, как следствие, способны прочно связываться с повторяющимися последовательностями в двух цепях двуспиральной ДНК. По такому принципу построены по крайней мере некоторые белки-репрессоры, в частности сrо-репрессор фага А Для нескольких семейств белков, взаимодействующих с нуклеиновыми кислотами, возможно, по-видимому, образование димеров из одинаковых (гомодимеры) и разных (гетеродимеры) субъединиц. Понятно, что функциональная роль гомо- и гетеродимеров существенно отличается, так как оказывается различной зона белка, способная связываться с соответствующим участком ДНК. Следовательно, само образование четвертичной структуры регулирует функцию таких белков.
4. Регуляторная функция. Главная функциональная особенность четвертичной структуры (по-видимому, смысл ее существования) состоит в том, что относительно слабые взаимодействия между субъединицами, характер которых существенно зависит от третичной структуры каждой из них, особенно удобны для регуляторных воздействий, управления активностью белков. Ввиду относительной слабости межсубъединичных контактов изменения в третичной структуре какой-либо субъединицы, вызванные ее взаимодействием с субстратом или иным лигандом, передаются на зону ее контакта с другой субъединицей, изменяя характер этой зоны. Такое изменение приводит к перестройке всей четвертичной структуры и обеспечивает передачу эффекта от одной субъединицы к другим, объединенным в ее рамках (см, например, гл. 8 и 12).
Зона контакта между субъединицами, будучи относительно слабым элементом белковой структуры, легко воспринимает и изменения, происходящие при посттрансляционной модификации белка, например при включении или отщеплении фосфатного остатка (см. гл. 11), что опять-таки используется как регуляторный механизм.
Примером белка, четвертичная структура которого обеспечивает очень сложную регуляцию, будучи и сама весьма непростой, является аспартаткарбамилтрансфераза Е. coli (рис. 7.4). В этом ферменте, ключевом в биосинтезе пиримидинов, шесть каталитических субъединиц С объединяются в два тримера, которые в ответ на присоединение субстратов могут в большей или меньшей степени взаимодействовать между собой. Регуляторные субъединицы R образуют три димера, имеющие контакт с каталитическими субъединицами. Это позволяет ингибировать фермент СТР (конечным продуктом пути биосинтеза пиримидинов) и активировать его АТФ, видимо, за счет изменения конформации регуляторных субъединиц, которое через перестройку четвертичной структуры передается на каталитические субъединицы. Стехиометрия четвертичной структуры фермента отвечает формуле (С3)2(R)3.
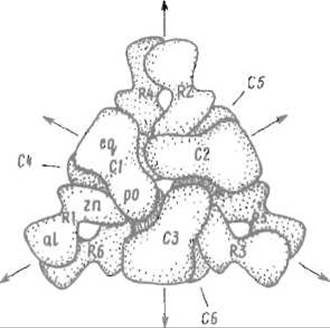
Рис. 7.4. Четвертичная структура аспартаткарбамилтрансферазы Е. coli.
С1-С6 — каталитические субъединицы, образующие два тримера С1-С3 и С4-С6; R1—R2, R3-R4 и R5-R6 — димеры регуляторных субъединиц; eq, po, zn и al — домены, из которых построены эти субъединицы; стрелками показаны оси симметрии